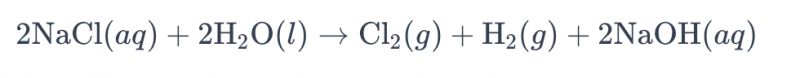Cyfeirir yn gyffredin at y broses o electrolysu hydoddiant heli gan ddefnyddio electrodau titaniwm i gynhyrchu clorin fel "electrolysis heli." Yn y broses hon, defnyddir electrodau titaniwm i hwyluso adwaith ocsideiddio ïonau clorid yn yr heli, gan arwain at gynhyrchu nwy clorin. Dyma'r hafaliad cemegol cyffredinol ar gyfer yr adwaith:
Yn yr hafaliad hwn, mae ïonau clorid yn cael eu ocsideiddio wrth yr anod, gan arwain at gynhyrchu nwy clorin, tra bod moleciwlau dŵr yn cael eu lleihau wrth y catod, gan gynhyrchu nwy hydrogen. Yn ogystal, mae ïonau hydrocsid yn cael eu lleihau wrth yr anod, gan ffurfio nwy hydrogen a sodiwm hydrocsid.
Mae'r dewis o electrodau titaniwm oherwydd ymwrthedd cyrydiad a dargludedd rhagorol titaniwm, sy'n caniatáu iddo adweithio'n sefydlog yn ystod electrolysis heb gyrydu. Mae hyn yn gwneud electrodau titaniwm yn ddewis delfrydol ar gyfer electrolysis heli.
Mae electrolysis dŵr hallt fel arfer yn gofyn am ffynhonnell bŵer allanol i ddarparu ynni ar gyfer yr adwaith electrolytig. Fel arfer, cyflenwad pŵer cerrynt uniongyrchol (DC) yw'r ffynhonnell bŵer hon oherwydd bod adweithiau electrolytig yn golygu bod angen cyfeiriad cyson o lif y cerrynt, a gall cyflenwad pŵer DC ddarparu cyfeiriad cerrynt cyson.
Yn y broses o electrolysu dŵr hallt i gynhyrchu nwy clorin, defnyddir cyflenwad pŵer DC foltedd isel yn gyffredin. Mae foltedd y cyflenwad pŵer yn dibynnu ar amodau adwaith penodol a dyluniad offer, ond yn gyffredinol mae'n amrywio rhwng 2 a 4 folt. Yn ogystal, mae dwyster cerrynt y cyflenwad pŵer yn baramedr hanfodol y mae angen ei bennu yn seiliedig ar faint y siambr adwaith a'r cynnyrch cynhyrchu a ddymunir.
I grynhoi, mae'r dewis o gyflenwad pŵer ar gyfer electrolysis dŵr hallt yn dibynnu ar ofynion penodol arbrofion neu brosesau diwydiannol i sicrhau adwaith effeithlon a chyflawniad y cynhyrchion a ddymunir.
Amser postio: Ion-16-2024